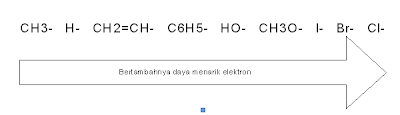
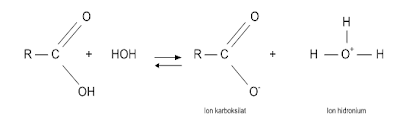
Pengertian hidrolisis
Secara teknis, hidrolisis adalah sebuah reaksi dengan air.
Reaksi inilah yang sebenarnya terjadi ketika ester dihidrolisis dengan air atau
dengan asam encer seperti asam hidroklorat encer.
Hidrolisis ester dengan basa melibatkan reaksi dengan ion-ion hidroksida,
tetapi hasil keseluruhannya sangat mirip sehingga dikategorikan dalam
hidrolisis dengan air atau asam encer.
Hidrolisis menggunakan air atau asam encer
Reaksi dengan air murni sangat lambat sehingga tidak pernah digunakan.
Reaksi ini dikatalisis oleh asam encer, sehingga ester dipanaskan di bawah
refluks dengan sebuah asam encer seperti asam hidroklorat encer atau asam
sulfat encer.
Berikut dua contoh sederhana dari hidrolisis menggunakan sebuah katalis
asam.
Pertama, hidrolisis etil etanoat:

dan yang kedua hidrolisis metil propanoat:

Perhatikan bahwa kedua reaksi di atas dapat balik (reversibel). Untuk
melangsungkan hidrolisis sesempurna mungkin, harus digunakan air yang berlebih.
Air diperoleh dari asam encer, sehingga ester perlu dicampur dengan asam encer
yang berlebih.
Hidrolisis menggunakan basa encer
Ini merupakan cara yang lazim digunakan untuk menghidrolisis ester. Ester
dipanaskan di bawah refluks dengan sebuah basa encer seperti larutan natrium
hidroksida.
Ada dua kelebihan utama dari cara ini dibanding dengan menggunakan asam
encer. Reaksinya berlangsung satu arah dan tidak reversibel, dan produknya
lebih mudah dipisahkan.
Mari kita mengambil contoh ester sama seperti kedua contoh di atas, tapi
menggunakan larutan natrium hidroksida bukan sebuah asam encer:
Pertama, hidrolisis etil etanoat menggunakan larutan natrium hidroksida:

dan selanjutnya hidrolisis metil propanoat dengan cara yang sama:

Perhatikan bahwa terbentuk garam natrium bukan asam karboksilat sendiri.
Campuran ini relatif mudah dipisahkan. Jika digunakan larutan natrium
hidroksida yang berlebih, tidak akan ada ester yang tersisa.
Alkohol yang terbentuk bisa dipisahkan dengan distilasi. Pemisahan ini cukup
mudah.
Jika anda menginginkan terbentuk asam bukan garamnya, anda harus menambahkan
asam kuat yang berlebih seperti asam hidroklorat encer atau asam sulfat encer
ke dalam larutan yang tersisa setelah distilasi pertama.
Jika anda melakukan ini, campuran akan dibanjiri dengan ion-ion hidrogen.
Ion-ion hidrogen ini ditangkap oleh ion-ion etanoat (atau ion paropanoat atau
ion apapun) yang terdapat dalam garam membentuk asam etanoat (atau asam
propanoat, dan lain-lain). Karena asam-asam ini adalah asam lemah, maka ketika
bergabung dengan ion hidrogen, cenderung tetap bergabung.
Sekarang asam karboksilat bisa dipisahkan dengan distilasi.
Hidrolisis ester-ester kompleks utuk membuat sabun
Pembahasan ini berkaitan dengan hidrolisis basa (dengan menggunakan larutan natrium
hidroksida) ester-ester besar yang ditemukan dalam lemak dan minyak hewani dan
nabati.
Jika ester-ester besar yang terdapat dalam lemak dan minyak hewani dan
nabati dipanaskan dengan larutan natrium hdiroksida pekat, reaksi yang terjadi
persis sama dengan reaksi pada ester-ester sederhana.
Terbentuk asam karboksilat – kali ini, garam natrium dari sebuah asam besar
seperti asam oktadekanoat (asam stearat). Garam-garam ini merupakan komponen
sabun yang penting – yaitu komponen yang melakukan pembersihan.
Juga terbentuk alkohol – kali ini, alkohol yang lebih rumit,
propan-1,2,3-triol (gliserol).

Karena hubungannya dengan pembuatan sabun, hidrolisis ester dengan basa
terkadang disebut sebagai
saponifikasi.
Sumber :
http://www.chem-is-try.org/materi_kimia/sifat_senyawa_organik/ester1/hidrolisis_ester/
Pertanyaan :
Pada reaksi hidrolisis dengan menggunakan asam encer , reaksi bersifat reversibel dan pada reaksi hidrolisis dengan menggunakan basa encer , reaksi tidak reversibel. pertanyaannya , dapatkah kita membuat reaksi hidrolisis dengan menggunakan asam encer menjadi reaksi yang tidak reversibel ?
jika iya, bagaimana caranya dan tolong jelaskan bersama reaksi nya ! dan jika tidak tolong jelaskan kenapa !