NAMA : Hidayah Chuswatun Chasanah
NIM : A1C111038
KELAS : Pendidikan Kimia Reguler 2011
UJIAN MID SEMESTER
MATAKULIAH :
Kimia Organik II
SKS : 3SKS
WAKTU :
Mulai Rabu, 24 April sampai dengan 1 Mei
2013 jam 24.00
PENGAMPU : Dr. Syamsurizal, M.Si
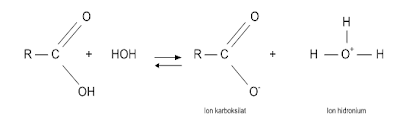
1. Asam karboksilat
dapat ditransformasi menjadi beberapa turunan. Buatlah skema reaksi perubahan
dari suatu ester menjadi amida selanjutnya target akhirnya adalah benzoil
khlorida.
Jawaban :
- Skema Reaksi
reaksi perubahan ester menjadi amida :
Suatu senyawa ester dapat
dirubah menjadi suatu senyawa amida dengan mereaksikan senyawa ester tersebut
dengan Amonia (NH3) . Pada reaksi ini , ester direaksikan dengan Amonia
(NH3) menghasilkan suatu senyawa amida dan juga alcohol. Disini alcohol
adalah merupakan hasil samping dari reaksi tersebut. Adapun reaksinya dapat
dituliskan sebagai berikut :
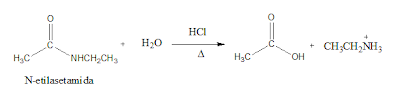
reaksi perubahan amida menjadi Benzoil Klorida :
Langkah selanjutnya yaitu
mengubah suatu senyawa amida menjadi suatu senyawa asil klorida yang mana
disini diubah menjadi benzoil klorida. Suatu senyawa amida yang diperoleh dari
reaksi diatas (reaksi antara ester dengan NH3) direaksikan kembali
dengan HCl sehingga pada reaksi ini menghasilkan senyawa benzoil klorida dan NH3.
Pada reaksi ini, NH3 merupakan hasil samping dari reaksi sintesis
benzoil klorida tersebut. Adapun reaksinya yaitu :
2. Temukan manfaat dari benzoil khlorida, jelaskan bagaimana mekanisme senyawa benzoil khlorida berperan.
Jawaban :
- Manfaat dari Benzoil Klorida yaitu mempercepat reaksi antara fenol dengan beberapa Asil Klorida yang kurang reaktif.
Benzoil klorida memiliki rumus molekul C6H5COCl.
Gugus -COCl terikat langsung pada sebuah cincin benzen. Senyawa ini jauh lebih
tidak reaktif dibanding asil klorida sederhana seperti etanoil klorida.
Fenol pertama-tama diubah menjadi senyawa ionik natrium fenoksida (natrium fenat) dengan melarutkannya dalam larutan natrium hidroksida.
Fenol pertama-tama diubah menjadi senyawa ionik natrium fenoksida (natrium fenat) dengan melarutkannya dalam larutan natrium hidroksida.
Ion fenoksida bereaksi lebih cepat dengan benzoil klorida dibanding fenol, tapi biarpun demikian reaksi tetap harus dikocok dengan benzoil klorida selama sekitar 15 menit. Padatan fenol benzoat terbentuk.
3.Bila benzoil khlorida dikonversi menjadi asam benzoat. Buatlah tiga contoh turunan asam benzoat sebagai model, kemudian jelaskan pengaruh efek resonansi terhadap kekuatan tiga jenis asam benzoat yang anda modelkan.
Jawaban :
Benzoil
Klorida dapat dikonversi menjadi asam benzoate yaitu dengan cara mereaksikan senyawa
benzoil klorida tersebut dengan air . Ketika benzoil klorida tersebut
direaksikan dengan air , OH- yang berasal dari air menggantikan
posisi Cl pada benzoil klorida . Kemudian terbentuklah asam benzoate dan HCl .
Adapun reaksinya adalah sebagai berikut :
Kemudian ada 3 turunan dari asam benzoat yang dimodelkan disini yaitu :
- Aspirin
Aspirin biasa digunakan sebagai obat penghilang
rasa sakit (analgesik) dan penurun panas (antipiretik). Oleh karena itu aspirin
juga digunakan sebagai obat sakit kepala, sakit gigi, demam dan sakit jantung.
Penggunaan dalam jangka panjang dapat menyebabkan iritasi lapisan mukosa pada
lambung sehingga menimbulkan sakit maag, gangguan ginjal, alergi, dan asma.
- Parasetamol
Parasetamol (asetaminofen)
memiliki fungsi yang sama dengan aspirin tetapi lebih aman bagi lambung. Hampir
semua obat yang beredar dipasaran menggunakan zat aktif parasetamol. Penggunaan
parasetamol yang berlebihan dapat menimbulkan gangguan ginjal dan hati.
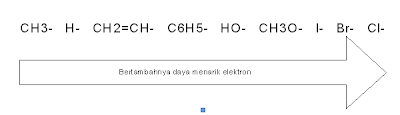
Pengaruh Resonansi
Resonansi terjadi karena adanya delokalisasi elektron dari ikatan rangkap ke ikatan tunggal. Delokalisasi elektron yang terjadi pada benzena pada struktur resonansi adalah sebagai berikut:
Hal yang harus diperhatikan adalah, bahwa lambang resonasi bukan struktur nyata dari suatu senyawa, tetapi merupakan struktur khayalan. Sedangkan struktur nyatanya merupakan gabungan dari semua struktur resonansinya. Hal ini pun berlaku dalam struktur resonansi benzena, sehingga benzena lebih sering digambarkan sebagai berikut:
Teori resonansi dapat menerangkan mengapa benzena sukar diadisi. Sebab, ikatan rangkap dua karbon-karbon dalam benzena terdelokalisasi dan membentuk semacam cincin yang kokoh terhadap serangan kimia, sehingga tidak mudah diganggu. Oleh karena itulah reaksi yang umum pada benzena adalah reaksi substitusi terhadap atom H tanpa mengganggu cincin karbonnya.
Resonansi terjadi karena adanya delokalisasi elektron dari ikatan rangkap ke ikatan tunggal. Delokalisasi elektron yang terjadi pada benzena pada struktur resonansi adalah sebagai berikut:
Hal yang harus diperhatikan adalah, bahwa lambang resonasi bukan struktur nyata dari suatu senyawa, tetapi merupakan struktur khayalan. Sedangkan struktur nyatanya merupakan gabungan dari semua struktur resonansinya. Hal ini pun berlaku dalam struktur resonansi benzena, sehingga benzena lebih sering digambarkan sebagai berikut:
Teori resonansi dapat menerangkan mengapa benzena sukar diadisi. Sebab, ikatan rangkap dua karbon-karbon dalam benzena terdelokalisasi dan membentuk semacam cincin yang kokoh terhadap serangan kimia, sehingga tidak mudah diganggu. Oleh karena itulah reaksi yang umum pada benzena adalah reaksi substitusi terhadap atom H tanpa mengganggu cincin karbonnya.
4. Usulkan turunan asam benzoat yang anda gunakan pada soal no.3 dapat dibiodegradasi oleh suatu mikroorganisme, bagaimana hasil akhir penguraiannya?
Jawaban :
Asam O-asetilsalisilat (aspirin) adalah turunan asam salisilat yang telah
dikenal sebagai prototip obat analgesik
kelompok NSAIDs. Sayangnya, stabilitas
senyawa ini menjadi salah satu kelemahannya,
di samping efek sampingnya.
Reaksi yang paling
berkontribusi dalam degradasi aspirin
adalah hidrolisis yang menghasilkan produk asam salisilat dan asam asetat. Reaksi ini berlangsung
dalam berbagai pH dan laju reaksinya mengikuti kinetika order pertama semu (Marr,2004)
tetapi dalam suasana yang lebih basa,aspirin terhidrolisis lebih cepat
(Reynolds, 1982).
Kemampuan
organisme tertentu untuk menurunkan senyawa aromatik dan hidrokarbon rantai
panjang yang luar biasa karena jenis molekul yang stabil untuk menyerang oleh
banyak agen aktif kimia. Namun, dibatasi untuk kelompok terbatas bakteri, yang
paling menonjol menjadi pseudomonad dan terkait Gram-negatif spesies, dan
beberapa jamur. Kapasitas untuk mendegradasi senyawa aromatik karena sintesis
enzim yang mengkatalisis penggabungan oxygenase langsung dari oksigen ke dalam
molekul substrat. Untuk molekul aromatik, pengenalan gugus hidroksil,
dikatalisis oleh enzim oksigenase, efek resonansi yang stabil dari cincin
benzena, sehingga membuat lebih rentan terhadap serangan oleh enzim yang
mengkatalisis oksigenase lanjut pembukaan cincin. Produk fisi cincin kemudian
lebih lanjut dimetabolisme, memproduksi intermediet dari siklus trikarboksilat
yang pada gilirannya dimetabolisme melalui siklus itu. Jalur kemungkinan untuk
degradasi asam asetilsalisilat oleh Acinetobacter
lwoffii.











.png)
.png)